E aí pessoal! Faz um tempinho que não aparece nada novo nessa blog não é!? :P
Mas para limpar a poeira está aqui um vídeozinho sobre Química Orgânica do nosso parceiro de sempre: O Vestibulando Digital!
Fiquem com Deus!
quinta-feira, 16 de maio de 2013
domingo, 30 de dezembro de 2012
Química do Ano Novo!
2012 está acabando e o mundo não acabou! rsrs :) e em nome de toda a equipe rocheda queremos agradecer o apoio e todas as visitas que recebemos durante todo o ano! Como falamos no decorrer do ano a química está sempre presente em nosso cotidiano, até no nosso Réveillon! um exemplo disso é o show de fogos de artifício que contemplamos na virada do ano. Para entrar no clima, separamos um artigo que explica como ocorrem as explosões que são um espetáculo a parte no romper do ano!
Alguns materiais podem emitir luz quando excitados. Isso ocorre quando os elétrons dos átomos absorvem energia e passam para níveis externos (maior energia), e ao retornar para os níveis de origem (menor energia), liberam a energia absorvida na forma de um fóton de luz. Temos então a luminescência, como o fenômeno é chamado.
A luminescência é usada, por exemplo, na produção dos fogos de artifício. Para entender a química presente nestes dispositivos precisamos entender um pouco da estrutura dos mesmos.
Os foguetes contêm um cartucho de papel no formato de cilindro recheado de carga explosiva. Esta carga diz respeito ao propelente, o responsável por disparar os fogos.
A pólvora negra é um dos propelentes mais utilizados, possui em sua composição uma mistura de salitre (nitrato de potássio), enxofre e carvão. Perclorato de potássio (KCLO4) também pode ser usado como propelente.
A pólvora negra é um dos propelentes mais utilizados, possui em sua composição uma mistura de salitre (nitrato de potássio), enxofre e carvão. Perclorato de potássio (KCLO4) também pode ser usado como propelente.
Para deixar os fogos de artifício coloridos, os fabricantes misturam à pólvora sais de diferentes elementos para que, quando detonados, produzam cores diferentes. Agora você já sabe dos segredos que compõem a linda explosão de cores admirada em momentos especiais, como por exemplo, nas festas de Réveillon.
Vejamos alguns dos compostos responsáveis pela coloração dos fogos:
Laranja: os sais de cálcio são responsáveis por esta coloração em foguetes.
Vermelho: a cor rubra surge da queima de sais de Estrôncio ou carbonato de Lítio.
Amarelo: obtido pela queima de Sódio.
Prata: o espetáculo da “chuva de Prata” é produzido pela queima de pó de titânio, de alumínio ou magnésio.
Dourado: o metal ferro presente nos fogos de artifício confere o tom de Ouro.
Azul: o aquecimento do metal cobre nos faz visualizar a cor azul.
Roxo: a mistura de Estrôncio e Cobre dá origem a essa bela cor.
Verde: a queima de Bário faz surgir o verde incandescente.
Referências:
http://www.brasilescola.com/quimica/quimica-presente-nos-fogos-artificio.htm
quinta-feira, 13 de dezembro de 2012
Energia de ionização
A energia de ionização , também conhecida como potencial de ionização , é a energia mínima necessária para “arrancar” um elétron de um átomo isolado e no estado gasoso, o potencial de ionização é uma propriedade periódica, pois quanto maior o tamanho do átomo ou do raio atômico, ou seja, quanto maior for o número atômico, menor será a energia de ionização, porque os elétrons estarão mais afastados do núcleo e a força de atração entre eles será menor.
Portanto, a variação da energia de ionização na tabela periódica, numa mesma família, aumenta de baixo para cima, e, num mesmo período, da esquerda para a direita,isso é mostrado abaixo, além dos valores das energias de ionização de vários elementos
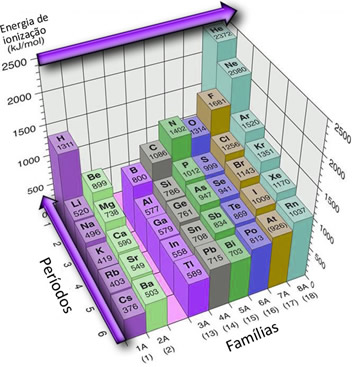
Esse crescimento é inversamente proporcional ao crescimento do raio atômico. É por isso que, conforme visto no texto , o sentido do crescimento dele na Tabela Periódica é exatamente o contrário (de cima para baixo, da direita para a esquerda) do sentido do aumento da energia de ionização.

Assinar:
Postagens (Atom)




