
Começaremos falando um pouco sobre o ar contido na atmosfera terrestre, e sua influência sobre a reações químicas. O ar seco e puro é uma mistura gasosa que contém 78,02% de N, 20,99% de O e 0,94% de Ar (Argônio), (além de porcentagens mínimas de outros gases nobres); O ar comum contém ainda umidade (vapor de água) e várias impurezas (monóxido, dióxido de carbono e etc). Para efeito de cálculo, costuma-se considerar que o ar tem aproximadamente 20% de O2 80% de N2 (juntamente com os outros gases) em volume.
Note que a proporção 20% de O2 : 80% de N2 : 100% de ar pode ser simplificada para 1 : 4 : 5, o que facilita extraordinariamente muitos problemas de cálculos estequiométrico, como podemos perceber pelas considerações feitas à seguir. Dos componentes do ar, somente o oxigênio costuma participar das reações, provocando combustões (queima), ustulações (oxidação de sulfetos metálicos e outras oxidações em geral ).
 |
| Ustulação (oxidação de sulfetos metálicos) |
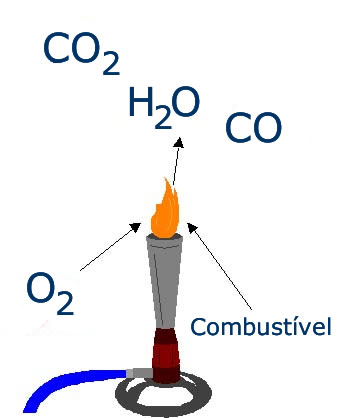 |
| Combustão(queima) |
O nitrogênio (e muito menos os gases nobres), não reage, a não ser em casos muito especiais;
Daí o motivo do nitrogênio ser chamado de "gás inerte".
Observação: Apesar do Nitrogênio não reagir, ele "ocupa volume" tanto no ar que reage quanto nos gases finais que são produzidos na reação...
Resolução de exercícios:
Outros casos particulares no Blog:
Caso I: Reações consecutivas
Caso II: Rendimento de uma reação
Caso III: Quantidade de dois ou mais reagentes
Caso IV: Impurezas do reagente
Referências:
Ricardo Feltre, Química Geral Vol.1.



show de bola véi! entendi tudo! vou arrasar na prova dessa semana la na minha escola!
ResponderExcluirVá com fé companheiro! ;D
ResponderExcluir