Casos Particulares de Estequiometria
Ai pessoal que visita o nosso humilde blog, continuaremos agora com cálculo estequiométrico falando dos casos particulares, abaixo está o primeiro caso: Quando ocorrem reações consecutivas.
Exemplo 1 - Ácido Sulfúrico ( H2SO4 )
Exemplo: Qual a massa de ácido sulfúrico produzido a partir de 8 toneladas de enxofre?
Dados: S = 32g/mol e H2SO4 = 98g/mol
1º) Observe quantas reações químicas são necessárias para se obter ácido sulfúrico a partir do enxofre:
S + O2 => SO2
SO2 + ½O2 => SO3
SO3 + H2O => H2SO4
Reação Global: S + 1½O2 + H2O => H2SO4
S + ½O2 + H2O => H2SO4
mol 32 98
massa 8 X
A massa de ácido sulfúrico produzido a partir de 8 toneladas de enxofre é = 24,5 Toneladas.
mol 32 98
massa 8 X
A massa de ácido sulfúrico produzido a partir de 8 toneladas de enxofre é = 24,5 Toneladas.
 |
| Pode até parecer água...Mas isso é Ácido Sulfúrico...Não mexa com isso se não for altamente treinado como nós! Esse troço queima!!! |
Exemplo 2 - Ácido Nítrico ( HNO3 )
O ácido nítrico surge a partir e algumas reações observem a equação dessas reações.
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 2NO + O2 → 2NO2
3) 3NO2 + H2O → 2HNO3 + NO

 Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico.
Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico.
Dados:
Massas molares em g/mol:
NH3: 17
HNO3: 63
NO2: 46
NO: 30
Vejamos a resolução:
NH3, está presente na reação 1).
HNO3, está presente na reação 3).
NO, participa das reações 1) e 2).
NO2, está presente nas reações 2) e 3).
Efetuando a multiplicação da equação 2) por 2, e a equação 3) por 4/3, obteremos:
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 4NO + 2O2 → 4NO2
3) 4NO2 + 4/3H2O → 8/3HNO3 + 4/3NO
É possível conseguir 8/3 mols de HNO3, a partir de 4 mols NH3.
Vejamos:
O ácido nítrico surge a partir e algumas reações observem a equação dessas reações.
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 2NO + O2 → 2NO2
3) 3NO2 + H2O → 2HNO3 + NO

 Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico.
Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico. Dados:
Massas molares em g/mol:
NH3: 17
HNO3: 63
NO2: 46
NO: 30
Vejamos a resolução:
NH3, está presente na reação 1).
HNO3, está presente na reação 3).
NO, participa das reações 1) e 2).
NO2, está presente nas reações 2) e 3).
Efetuando a multiplicação da equação 2) por 2, e a equação 3) por 4/3, obteremos:
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 4NO + 2O2 → 4NO2
3) 4NO2 + 4/3H2O → 8/3HNO3 + 4/3NO
É possível conseguir 8/3 mols de HNO3, a partir de 4 mols NH3.
Vejamos:
Resolução do problema sem executar o balanceamento da equação:
- Cálculo da quantidade de NO2 que será preciso para adquirir 6,3g de HNO3.
- Cálculo da quantidade de NO que será preciso para adquirir 6,9g de NO2.
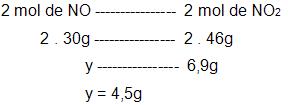
Cálculo da quantidade de NH3 que será preciso para adquirir 4,5g de NO.
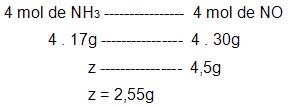
Abaixo está uma "importante" função do Ácido Nítrico:
 |
| Fabricação de Explosivos...BUM!!!! hehehehe...(Não façam isso em casa)...Nãããããããããoooo....eles fizeram...droga! |
Bem pessoal...terminamos aqui com o primeiro dos casos "especiais" de cálculo estequiométrico, saiba que no nosso blog também existem os outros casos, postados pelos meus coleguinhas rochedos e também outras formas de aprendizagem que podem lhe ajudar no momento da questão...e saiba também que o real aprendizado deste assunto vem com muita prática (resolução de exercícios)...então... muito obrigado por visitar nosso blog...
Outros casos particulares por aqui:
Caso II: Rendimento de uma reação
Caso III: Quantidade de dois ou mais reagentes
Caso IV: Impurezas do reagente
Caso V: Participação do ar nas reações
And For Those About To Chemistry (We Salute You!)...Yeah!!!...





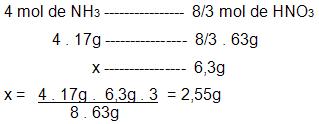
Valeu meu chapa! Me ajudou bastante! ^^
ResponderExcluir